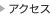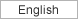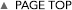タンパク質リジンメチル化の生物学
これまで様々な生命現象のシグナルカスケードが解析されてきたが、そこでは、タンパク質(分子)間の相互作用の調節が重要な作用点として働いていることがわかっている。細胞内の局在を換えることで、或は分子の構造を換えることでタンパク質間の相互作用が調節される。この調節には、タンパク質の化学修飾が重要な役割を果たしている。例えば、リン酸化がタンパク質内の構造変換を誘導したり新たなタンパク質の結合部位を生み出したりすることにより、タンパク質間の相互作用が制御されている。
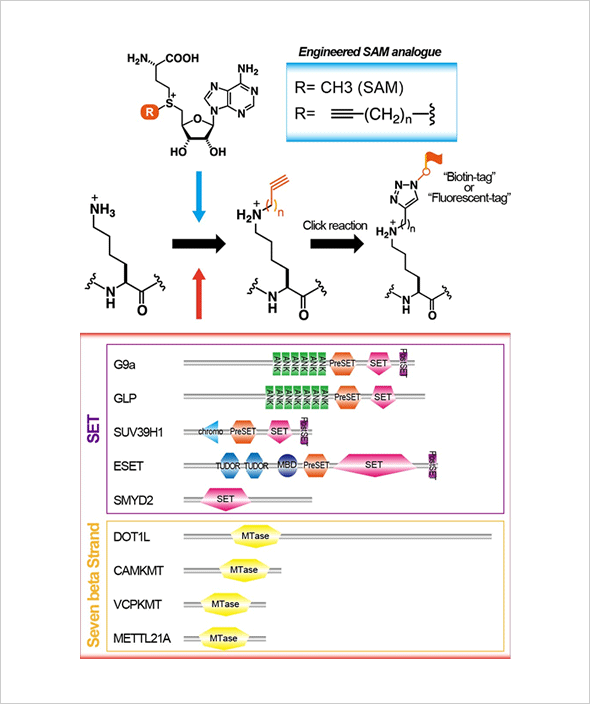
近年、蛋白質リジン残基のメチル化酵素が動物細胞でもいくつも同定され、特にヒストンのリジンメチル化が様々なクロマチン機能制御に関わることが示されてきた。この場合も、ヒストン・リジンメチル化修飾の重要な機能は、ヒストンの異なるリジン残基がメチル化修飾を受けることで異なる機能分子をそのクロマチン領域にリクルートする(つまり、タンパク質間の相互作用を調節する)ことにあった。これまで解析されてきたリジンメチル化酵素のほとんどはSETドメインをもつ分子に限られて来た。そして、SETドメイン分子の標的の中心がヒストンだったこともあり、リジンメチル化の研究はほとんどヒストンに限局して進んで来た(そして多くの進展があった)。しかし、他の翻訳後修飾酵素が様々なタンパク質を標的とすること、タンパク質のメチル化でもアルギニン残基に対するメチル化酵素はヒストンを含む様々なタンパク質を標的としている。これらのことを考えると、リジンメチル化に関してもヒストン以外の様々なタンパク質を標的とし、その機能制御に関わっていることが予想される。さらに最近では、SETドメインを持たないクラス(Seven beta strand enzymes別名“Class I” methyltransferases)のリジンメチル化酵素もたくさん見つかって来ており、これらの酵素はヒストン以外を標的とすることも示されつつある。そこで、まずはリジンメチル化酵素の新規標的因子の網羅的検出系の確立を目指したい。具体的には、様々なプローブの付加を可能にするような変異型SAMを開発しメチル基ドナーとして用いることで、高感度あるいは酵素特異的なメチル化標的因子の検出系の確立を目指す。そして、それを活用しながら、リジンメチル化修飾の生命機能制御における役割の解明を進めたい。