新たなモデル動物による疾患の分子機構の解明
自閉症圏障害 (autism spectrum disorders)の一つにRett症候群という現在治療法のない疾患がある。Rett症候群は、自閉症・てんかん・失調性歩行・特有の常同運動(てもみ動作)・知能や言語能力の低下などを特徴とするX連鎖優性遺伝病で、発生率は女子1万人に1人(男子は胎生致死)、1999年に原因遺伝子がMeCP2であることが判明した。MeCP2分子はメチル化されたDNA(シトシン)に特異的に結合する。その後、MeCP2のヘテロKO♀マウスがRett症候群の多くの特徴を示すこと・遅発性の発症を示すことから、MeCP2 KOマウスはRett症候群のモデル動物として認知され、多くの研究がなされてきた。
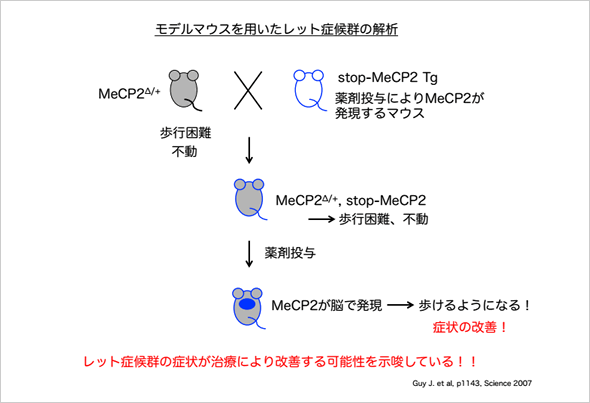
2007年、MeCP2 KOマウスを用いて、生後に機能していないMeCP2を回復させることで表現型の発生の阻止や症状の進行抑制あるいは改善がどのくらい可能かが検討された(文献)。♂のMeCP2 KO (MeCP2stop/y)マウスは生後6週前後で活動能の低下・歩行不全・振戦(不随意的な四肢または体幹の震え)・後肢の伸展・不規則な呼吸などの症状が現れ、発症後11週以内に致死となる。一方、Rett症候群の最も近いモデルである♀のMeCP2ヘテロ欠損 (MeCP2stop/+)マウス(ランダムなX染色体の不活性化により、活性化しているアリールのX染色体上のMeCP2が欠損している細胞ではMeCP2が発現していない)では、寿命はwtとほぼ同じであるものの生後4-12ヶ月で活動能の低下・歩行不全・不規則な呼吸・後肢伸展などの症状が現れ、その症状がずっと維持される。遺伝学的に、♂のMeCP2stop/yマウスの症状が現れる前あるいは発症の初期にMeCP2の発現を回復させることで、発症の阻止と延命(表現型が現れる前にMeCP2の発現を回復させた場合)、症状の改善あるいは進行阻止と延命(発症の初期にMeCP2の発現を回復させた場合)がなされることが示された。MeCP2stop/+ヘテロ欠損♀マウスに於いても、発症初期あるいは中期に欠損しているアリールのMeCP2の発現を回復させてやると、症状が消失あるいは改善することが分かった。この報告は、もちろんRett症候群の発症予防や発症した患者の治療に直ぐに応用できるものではないが、モデル動物を用いた解析だからこそ解明することが出来た、「Rett症候群は治療可能な(可逆的な)疾患である」ことを指示した初めてのものであり、今後の創薬研究を含む治療戦略に重要な方向性を示した点で高く評価されている。
H3K9のメチル化修飾は、通常転写抑制のエピゲノム情報として広く使われている。これまでの研究により、H3K9メチル化酵素のG9aとGLPはG9a/GLPヘテロ複合体を形成し、生体のH3K9メチル化を広く制御することが明らかとなっている。近年、GLP(/EHMT1)はヒトの遺伝性の発達障害・精神神経疾患である9q34サブテロメア欠失症候群(Kleefstra症候群)の原因遺伝子であることが判明した。Kleefstra症候群は、重篤な精神遅滞・発達遅延・低緊張・特徴的な顔面異形を主な症状とする遺伝性精神神経疾患である。GLPおよびG9aの脳特異的KOマウスは、行動異常や学習不全といった9q34サブテロメア欠失症候群で見られる表現型を示すことから、この精神神経疾患のモデル動物と認知されている。そこで我々は、Kleefstra症候群マウスモデル(GLP欠損マウス)を用いて、ヒトの精神神経疾患とH3K9メチル化制御の関係に焦点を絞り、前述したRett症候群マウスモデルで示されたようなエピゲノム制御不全に起因する疾患(表現型)の可逆性が一般的に存在するのか、検討している。